-
[notes] Liaisons covalentes
Dans une liaison covalente, la différence d'électronégativité n'est pas suffisante pour qu'un électron soit arraché. Les deux atomes partagent (en général) une paire d'électrons. Chacun partage et reçoit en partage un électron.
D'après la règle de l'octet, un électron ne peut faire de liaisons covalentes que jusqu'à concurrence de 8 électrons sur la couche de valence, donc dans la plupart des cas (sauf règle du duet):
nombre de liaisons covalentes = (8-nombre d'électrons de couche de valence)
Par exemple pour l'oxygène, qui a 6 électrons sur sa couche de valence peut faire 2 liaisons covalentes (6+2=8). C'est pourquoi il est dit divalent. Le carbone n'a que 4 électrons sur sa couche de valence (1s22s22p2), il peut donc faire 4 liaisons covalentes et est par conséquent dit tétravalent.
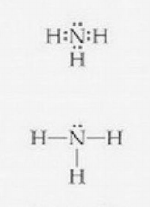
Dans la représentation avec les points, on voit tous les électrons, y compris ceux mis en commun. Dans la représentation avec les traits, un trait vaut deux électrons. (À droite, une molécule d'ammoniac)
-
Commentaires
