-
 Je lis un livre depuis le début de mon étude de la chimie organique, Invitation à la chimie organique, Johnson, 1999.
Je lis un livre depuis le début de mon étude de la chimie organique, Invitation à la chimie organique, Johnson, 1999.Je trouve que c'est une grande chance de pouvoir lire en français quand j'apprends quelque chose de nouveau.
Ce livre est très gros et me semble très complet, il me convient bien. Cela ne m'empêche pas d'aller régulièrement consulter internet pour chercher les réponses aux multitudes de questions qui se posent à chaque page.
Ce que j'aime dans ce livre, c'est qu'à chaque fois que je me pose une question, que j'arrive ou non à y répondre précisément grâce à mes recherches, il contient la réponse à la page suivante, avec un dessin pour me permettre de bien comprendre. <3
Hier je me suis posée la question de la forme de l'orbitale moléculaire de l'eau [ici].
Hier soir, j'ai eu la chance d'avoir une conférence surprise sur le LASER reprécisant une partie de l'organisation de la matière, me permettant de constater que j'avais bien compris ce que j'avais étudié et de poser des questions pertinentes. :D
J'ai enfoncé le clou sur les états d'excitation des atomes/molécules. Un atome cherche toujours à retrouver son état de plus faible énergie, mais quand on l'excite (par exemple avec de l'électricité ou de la lumière) son orbitale change, les électrons changent de parcours. Il y a donc plusieurs configurations possibles pour une même molécule, étant donné ses différents états d'excitation.
Ce matin, je me suis réveillée et j'ai commencé par chercher cette orbitale moléculaire. Cela reste confus et un peu complexe, mais en réfléchissant et en dessinant, j'ai pu mettre de l'ordre dans mes acquisitions.
Les électrons sont de charge négative, donc ils se repoussent. Ils sont attirés par les noyaux, de charge opposée, mais se repoussent entre eux. (Sans parler du spin, pour lequel j'ai trouvé des vidéos, mais ce n'est pas encore clair clair.)
Ces interactions électro-magnétiques dessinent des courbes orbitales qui se complexifient avec les entassements de couches et de sous-couches.
J'ai compris les liaisons sigma, pi, phi... entre deux sous-couches de même type, mais pas compris comment des sous-couches de type différent, par exemple p et s se combinent. Je n'ai pas non plus compris comment deux sous-couches de même type peuvent se combiner puisqu'il y a des sous-couches de type différent entre les deux.
Mais seule la couche de valence devient couche moléculaire, puisque seuls les électrons de la couche de valence se combinent. C'est déjà ça.
J'ai trouvé les diagrammes de Walsh [wikipédia], qui permettent de prédire avec une bonne précision les formes des orbitales moléculaires et de jolis dessins. Je ne comprends pas encore les formules mathématiques correspondantes.
J'ai trouvé un site présentant de nombreuses configuration pour l'eau, le sujet me semble aussi vaste que sa proportion sur terre. Belles promesses de découvertes à venir. Pour l'instant, je n'ai rien compris. J'ai trouvé de nombreux sites passionnants, dont la moitié en français (si!) et sur l'un d'eux, cette image (ici):
 Eurêka! Tout le monde semble d'accord sur la représentation de la molécule d'eau comme un tétraèdre (logique puisque les électrons se repoussent le plus loin possible de façon égale) et donc, quelle que soit la disposition choisie, les deux atomes d'hydrogène sont forcément collés à deux orbitales voisines.
Eurêka! Tout le monde semble d'accord sur la représentation de la molécule d'eau comme un tétraèdre (logique puisque les électrons se repoussent le plus loin possible de façon égale) et donc, quelle que soit la disposition choisie, les deux atomes d'hydrogène sont forcément collés à deux orbitales voisines.Dans mon dessin d'hier, je pensais que les électrons faisaient un circuit en passant tour à tour de chaque côté du noyau, comme dans une bourrée 2 temps (Playmobil de démo). Aujourd'hui je pense au contraire que le dessin en «8» de la sous-couche p était une simplification. Il semble que sous toutes les images que je trouve, il y ait une rupture au niveau du noyau. Comme dans cette image où les différentes orbitales ne se touchent pas. Mais si tel est le cas, je ne m'explique pas la forme de l'orbitale p avec un seul électron par orbitale. Il me reste donc des recherches à faire dans ce domaine.
 Peut-être est-ce une combinaison des deux.
Peut-être est-ce une combinaison des deux.Je vais continuer à lire mon livre, j'ai vu qu'il expliquait certaines orbitales moléculaires ensuite. héhéhé. J'ai aussi trouvé un autre livre, pour diversifier mes entrées et mieux gérer la fatigue cognitive en ne me focalisant pas sur un seul problème.
C'est un livre publié par l'université de Grenoble. J'aime beaucoup les publications de Grenoble. En psychologie, ils ont des livres passionnants et en français, valorisant la recherche Française, très pertinente. Le livre dont je parle aujourd'hui est un livre écrit pour l'autoformation en chimie. La présentation change de celle des livres destinés aux étudiants de prépa et autres examens de fac ou d'école, c'est rafraîchissant.
 votre commentaire
votre commentaire
-
Soient deux atomes d'hydrogène (Z=1, H=1s1) et un atome d'oxygène (Z=8, O=1s22s22p4). Sur la couche de valence de H, 1 atome, sur celle de O, 6 atomes.
![[opinion] où se placent les atomes d'H dans une molécule d'eau?](http://ekladata.com/VpJFOkyQyvo7_35GAFOtxDq5ITw@250x221.png) Parmi ces 6 atomes, deux sont sur l'orbitale s, donc les H ne pourront pas s'y attacher. 4 sont sur les orbitales p. On sait que les couches p se remplissent toutes avant de doubler leurs électrons (avec un électron de spin opposé). Sur les 3 orbitales p, une seule est donc remplie et les deux autres n'ont qu'un électron.
Parmi ces 6 atomes, deux sont sur l'orbitale s, donc les H ne pourront pas s'y attacher. 4 sont sur les orbitales p. On sait que les couches p se remplissent toutes avant de doubler leurs électrons (avec un électron de spin opposé). Sur les 3 orbitales p, une seule est donc remplie et les deux autres n'ont qu'un électron.Les atomes H vont faire des liaisons covalentes sur ces orbitales incomplètes. Deux atomes H, deux orbitales différentes, donc impossible qu'ils soient diamétralement opposés. Pas impossible a priori qu'ils soient l'un à côté de l'autre, mais électriquement, cela semble improbable. Je dirais qu'ils doivent être placés comme sur mon dessin. J'espère avoir la réponse bientôt! ^__^ (Mickey est une goutte d'eau...)
Je me demande le trajet que parcourent les électrons «communs» de la liaison covalente. Le suspense est insoutenable. La suite!
 votre commentaire
votre commentaire
-
Dans une liaison covalente, la différence d'électronégativité n'est pas suffisante pour qu'un électron soit arraché. Les deux atomes partagent (en général) une paire d'électrons. Chacun partage et reçoit en partage un électron.
D'après la règle de l'octet, un électron ne peut faire de liaisons covalentes que jusqu'à concurrence de 8 électrons sur la couche de valence, donc dans la plupart des cas (sauf règle du duet):
nombre de liaisons covalentes = (8-nombre d'électrons de couche de valence)
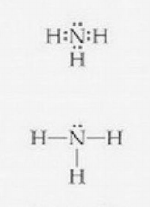
Par exemple pour l'oxygène, qui a 6 électrons sur sa couche de valence peut faire 2 liaisons covalentes (6+2=8). C'est pourquoi il est dit divalent. Le carbone n'a que 4 électrons sur sa couche de valence (1s22s22p2), il peut donc faire 4 liaisons covalentes et est par conséquent dit tétravalent.
Dans la représentation avec les points, on voit tous les électrons, y compris ceux mis en commun. Dans la représentation avec les traits, un trait vaut deux électrons. (À droite, une molécule d'ammoniac)
 votre commentaire
votre commentaire
-
Il existe deux types de liaisons chimiques: les liaisons ioniques et les liaisons covalentes.
Dans les deux cas, il est important de considérer la notion d'électronégativité.
Cette notion est difficile pour moi puisque les atomes sont censés être neutres à la base et je trouve que le vocabulaire est mal choisi. Il s'agit en fait du pouvoir qu'a (ou pas) un atome d'attirer les électrons. Moins l'atome a de protons (petit diamètre), plus il a d'électrons sur sa couche de valence, plus il est électronégatif. [ref.]
À cause de la règle de l'octet: un atome qui a peu d'électrons sur sa couche de valence va «chercher» à en perdre pour se stabiliser, au contraire d'un atome qui en a beaucoup et qui va donc «chercher» à la compléter pour se stabiliser comme le gaz rare le plus proche de lui. [cf. article atome]
L'échelle de Linus Pauling va de 0,7 (faiblement électronégatif) à 4,0 (fortement électronégatif). Si un atome est fortement électronégatif, on le dit électronégatif. (mmmh)
Une liaison ionique est une liaison entre un cation et un anion, provoquée par attraction électrostatique.
Les ions d'une telle liaison se forment lorsqu'un atome fortement électronégatif rencontre un atome faiblement électronégatif. Si la différence d'électronégativité est suffisante, un des atomes cède un ou plusieurs électrons de valence à l'autre.
Les atomes des colonnes VI et VII sont très électronégatifs et les atomes des deux premières colonnes le sont très peu, ensemble ils ont tendance à former des sels inorganiques.
Par exemple, le fluorure de lithium (LiF) est cristallin à l'état solide (chaque ion est entouré de six ions de l'autre élément). L'eau peut assurer la séparation des ions. Les sels sont facilement solubles et contiennent donc des ions séparés les uns des autres.
Le lithium, de formule 1s22s1 (Z=3) n'a qu'un électron sur sa couche de valence. Il va le perdre au profit du fluor, de formule 1s22s22p5 (Z=9). Il gagne ainsi une configuration électronique semblable à celle du gaz rare Hélium et le Fluor qui avait 7 électrons sur sa couche de valence devient par la même électroniquement semblable au gaz Néon.
Exercice: Et avec NaCl? (Na: Z=11, col Ia)(Cl: Z=17, col VIIa)
 votre commentaire
votre commentaire
-
Él. nb. Z Config. élec. | nb élec. ss-couche -> 1s 2s 2px 2py 2pz 3s H 1 1s1 1 He 2 1s2 2 Li 3 1s2 2s1 2 1 Be 4 1s2 2s2 2 2 B 5 1s2 2s2 2p1 2 2 1 C 6 1s2 2s2 2p2 2 2 1 1 N 7 1s2 2s2 2p3 2 2 1 1 1 O 8 1s2 2s2 2p4 2 2 2 1 1 F 9 1s2 2s2 2p5 2 2 2 2 1 Ne 10 1s2 2s2 2p6 2 2 2 2 2 Na 11 [Ne] 3s1 2 2 2 2 2 1 selon la répartition des électrons sur couches et sous-couches
 votre commentaire
votre commentaire





